2022年10月22日 第51回 日韓技術士国際会議
N&Y技術士事務所 米田則行
Abstract
Gene therapy, nucleic acid medicines and cell therapy handling human DNA or RNA have been put into practical use as well as nano DDS(drag delivery system) applied to unstable drag inside body and further to concentrate to the target organs. Historical review and future insight of advanced pharmaceuticals are discussed.
1 はじめに
遺伝子操作技術は、ヒトではなく微生物や動物細胞のDNAを組換えることにより、目的とする遺伝子を発現させて蛋白質合成を行ってきたが、近年、遺伝子治療薬や細胞療法として直接ヒトの細胞を対象にできる段階となり、難病に対し新機序による次世代Bio医薬と医療を提供している。遺伝子操作技術の発展によって開発された医薬品とその実用化に重要となったDDS(drag delivery system)について、現状を概観し今後の展望を報告する。
2 遺伝子操作技術の発展と医薬品開発
1982年、化学合成では難しかったInsulin等の蛋白質は、大腸菌へのPlasmid vectorsによる目的蛋白質に対応した遺伝子導入で量産可能となり、第1世代Bio医薬品が誕生した。更に分子量が大きく複雑な糖蛋白である抗体の生産は、Chinese hamster卵巣細胞(CHO)への遺伝子導入によって実現し、現在の医薬品上位売上げを占める抗体医薬へと発展した。抗体医薬は第2世代Bio医薬品といわれ抗がん剤、免疫疾患に広く使われている。2012年、Adeno随伴Virus(AAV)に欠損遺伝子DNAを組込んだ遺伝子治療薬の人体への全身投与によって直接のGenome遺伝子操作(in vivo)が実用化された。また、2017年には人の免疫細胞を体外でVirus vectorによって抗CD-19抗原遺伝子導入を行った(ex vivo)後に自己投与するChimera抗原T細胞(CAR-T)療法が開始された。RNAを主体とする核酸医薬は10-50塩基からなるOligo核酸であり、細胞内で遺伝子発現を直接制御して疾患を治療する医薬である。RNAの薬剤への適用において、生体内で酵素や免疫系に捕捉分解されやすい点は化学修飾と脂質Nano粒子(Lipid Nano Particle)の物理的閉じ込めで逃れ、細胞膜通過が困難な点はLNPや誘導分子を結合して細胞内へ薬剤送達が行われている。
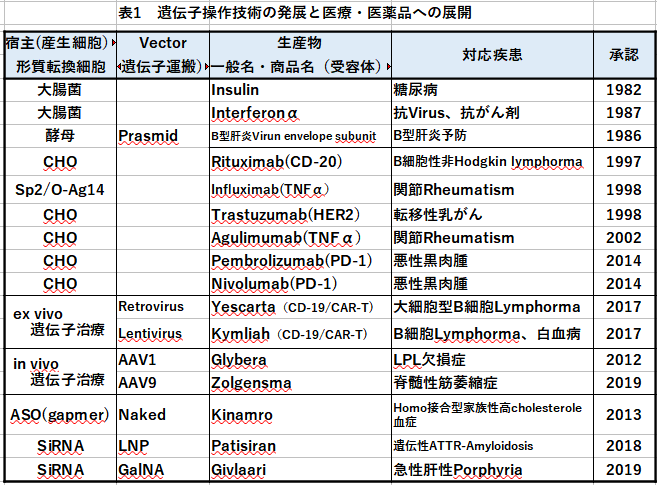
2.1 遺伝子組換え
表1に示した医薬品は、図1に示す制限酵素によるPlasmidの切断や目的DNAの切り出しと、DNA-ligaseによる接合で合成された遺伝子導入Plasmid vectorを直接あるいはVirus vectorの力を借りて宿主細胞にPlasmid-DNAあるいは染色体DNAに組込む技術によっている。組換えとは遺伝子の追加導入組込みである。
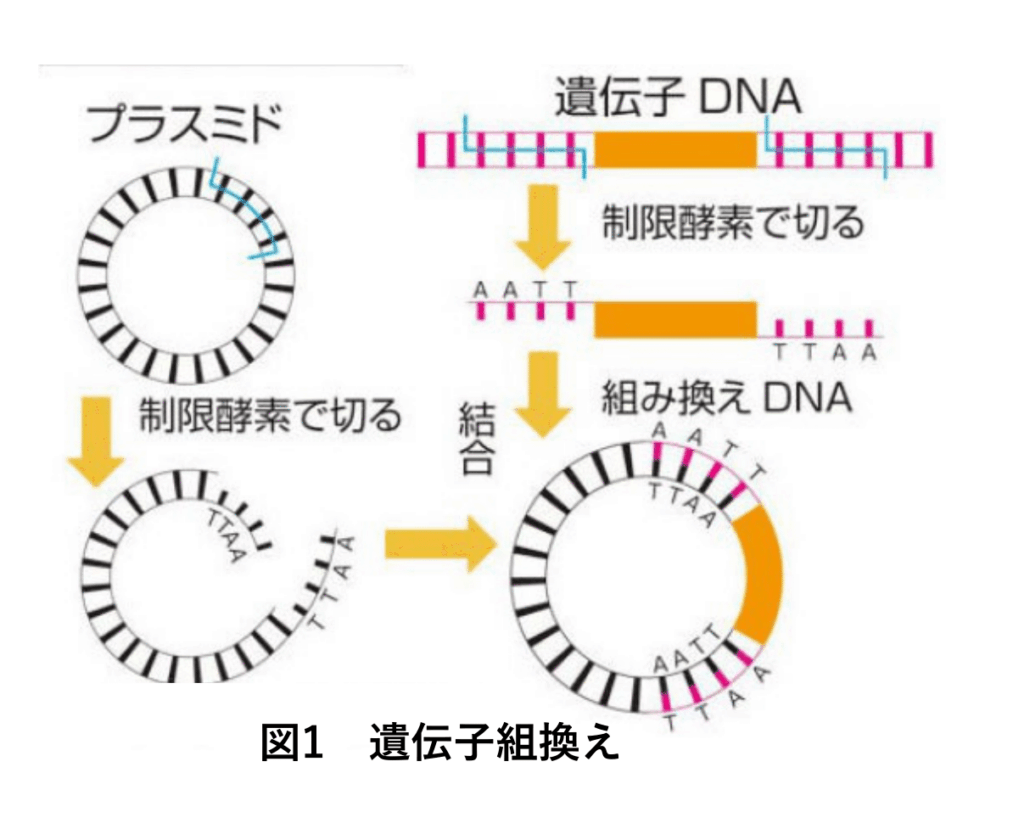
2.2 遺伝子編集
遺伝子組換え技術は各種制限酵素があるものの、切断可能なDNA配列が決まっており、改変可能な生物種が限定された。異常遺伝子が残存し、導入箇所や発現は偶然に支配されるため、組換え後の多くの細胞から目的に合致した細胞の選別が必要であった。そこで、人工制限酵素ZFN(1996年)、TALEN(2010年)に続きCRISPR-Cas9(2012年)が開発され、任意のDNA配列部分を破壊でき(遺伝子knock-out)、任意のDNA配列に組換え(遺伝子knock-in)可能な編集技術が提供された。(図2) 海外では農業や漁業で実用されており、2020年には遺伝性Transthyretin(TTR)-amyloidosisにLNPをDDSとしたCRISPR-Cas9を用いた遺伝子knock-out治療薬の第1相臨床試験が開始され、肯定的な結果が得られている。遺伝子治療が染色体DNAの治療で根治的なものである一方で、予期せぬ変異導入(off-target効果)や大きな欠失が起きる可能性も指摘されている。それに対して、2016年にGenomeの2本鎖切断することなく目的部位の1塩基を書換えする1塩基編集(Base Editing)、更に2019年にPrime編集(Prime Editing)として、人工的にCas 9 -Nuclease、逆転写酵素、Prime guide RNAを組合せて任意の配列箇所の塩基を任意の塩基に書換えるDNA編集が提案された。Off-targetなく病原性遺伝子変異を補正する遺伝子治療として注目される。
3 Nano DDS技術
DDSとは、粒子径や親水性、疎水性、pH応答性、生体内安定性等の物理化学的性質を利用して、薬物体内動態を受動的に、薬剤に抗体、糖鎖、蛋白質等を結合させ標的組織指向性を能動的に制御し、副作用を最小とし効果を最大とした薬物運搬技術である。
3.1 脂質Nano粒子(LNP)
LNPは細胞膜と同様にりん脂質2重膜から形成された粒径50-150nmの集合体である。粒径から腎臓から排出されず、肝臓あるいは腫瘍新生血管に集積されやすく(ERP効果)、内側に薬物を閉じ込め目的臓器や細胞へ運搬できる。内側に水相と水溶性薬剤を保持するものはLiposomeと呼ばれ、抗がん剤:Doxorubicin(1995年)に実用化されている。核酸保持にはCation脂質との結合により水相は必要なく、LNPはSiRNA核酸医薬:Patisiran(2018年)、mRNAを使用する新型COVID-19 vaccine(2020年)に適用・実用化されている。LNPに使用される脂質とその配合はDDS機能を実現するための高度な技術である。外殻を①Poly-ethylene-glycol(PEG)化(0.2-2mol%)して血中安定滞留時間を延ばし(Stealth性)、②pH応答性を付与した3級AmineからなるCationic脂質(50-60mon%)、③Cholesterol(30-40mol%)、④中性りん脂質(4-10mol%)によって負電荷を帯びた細胞膜との融合と、Endocytosis後の酸性環境下の薬剤のEndosome脱出を促進している。尚、生体由来liposomeである細胞外小胞(Exosome)は、外表面の糖鎖や受容体蛋白質等による生体適合性、安定性と標的指向性(がんの転移に関連)を備えており、LNPの構成原材料と参照組成として期待されている。

3.2 高分子Micelle
PEG(親水性)とCationic poly-amino酸(疎水性)をBlock共重合したCationic高分子は、AnionとなるDNA,RNA等と結合してPoly-ion複合体(~10nm)となる。AnionのSizeや比率により小粒径(~40nm)のUnit複合体から40~100nm粒径の高分子Micelleを形成する。(図3) ここで、PEG側では先端に誘導機能を持つ分子を結合し、Poly-amino酸側では細胞内の酸性下あるいは還元条件下で切断される結合によって薬剤を結合し、Stealth機能を持ち目的組織まで運搬され当該細胞内で初めて分解作用する副作用が抑制されたDDSが臨床段階で検討されている。誘導機能分子については抗体薬物複合体(ADC)や核酸医薬でN-Acetylgalactos-amine(GalNAc)によるAsialo-glycoprotein受容体への送達が実用化されている。脳腫瘍やAlzheimer病の治療は血液-脳関門のSizeが10nm程度で高分子医薬が送達できなかったが、Glucose(Glc)を結合し、脳のGlc-transporter(GLUT1)経由で可能であることが明らかにされ、検討が期待されている。
4 新型COVID-19 vaccine開発
4.1 組換え抗原蛋白質vaccine
B型肝炎VaccineでVirusの Envelope subunit を遺伝子組換えによって産生させる技術は確立されていた。Novavax社はこの技術基盤によって昆虫に遺伝子組換えによるSpike蛋白質を産生させ、Vaccine製剤を開発したものといえる。
4.2 Virus vector vaccine
J&J社ではAdeno virusをVectorとしたEbola virus vaccinationを実用化しており、このPlatformにて遺伝子配列をEbola virusから新型COVID-19 virusに変更し、Spike蛋白質をCodeしたAdeno virus vectorを短期間で開発できたと思われる。本Vaccine投与は抗原蛋白質の細胞内生産を可能とする染色体DNA組込みなしの一過性in vivo 遺伝子操作といえる。
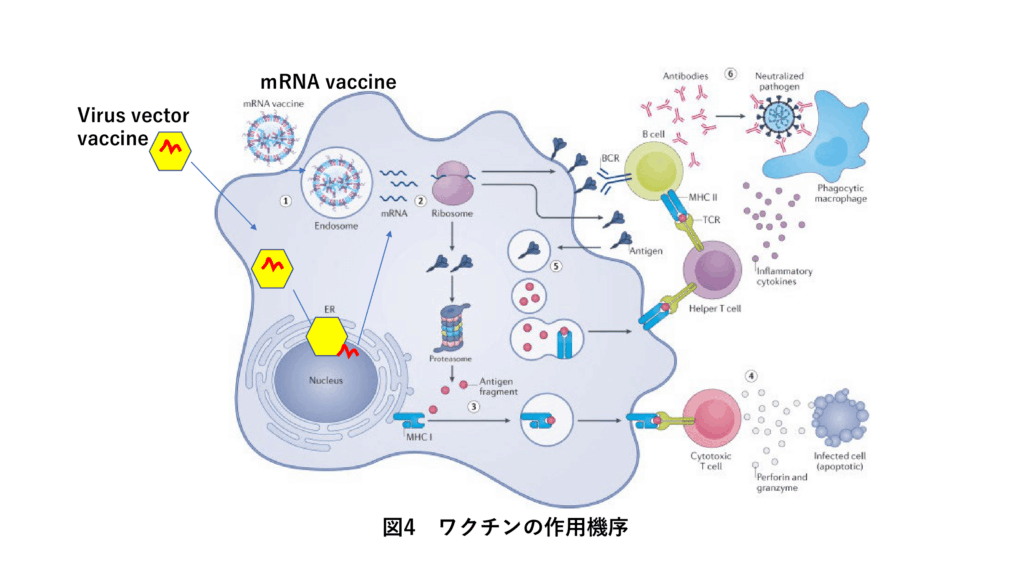
4.3 mRNA vaccine
核酸医薬とLNPによるDDSは新型COVID-19 virus mRNA vaccineの基盤技術となった。BioNTechやModerna社は、核酸医薬においてRNAの分解抑制に用いられる化学修飾を応用し、DDSに SiRNAのPatisiranのLNPの組成を活用した。特にRNAの配列のU(Uridine)をすべてΨ(Pseudo Uridine)に変更することによりRNA分解酵素から逃れ、かつ蛋白質合成能がむしろUより高いことを見いだして実現に結びつけたのは特筆に値する。このmRNAには新型COVID-19 virusのSpike蛋白質がCodeされており、翻訳によりSpike蛋白質が生成され抗体生産や免疫系体制が構築されるVaccine機能をはたす。(図4) 短期間の実用化は、次世代Bio医薬品の技術蓄積なくしてはあり得ず、これがあって初めて可能となったもので、世界の人々の競争と協力により、臨床試験、生産、行政が圧倒的な速さで動かされた結果である。
5 今後の展望
次世代Bio医薬品は、更に設計通りの編集が可能となる遺伝子編集技術と、送達困難であった組織細胞へのDDS技術の改良によって発展していくと期待できる。研究と商業生産には大きな隔たりがあり、医薬品生産技術の確立、すなわち効率的な合成だけではなく、精製、製剤、包装、品質評価、有効性、安全性評価など多岐にわたる課題を一体としてとらえ、解決することが求められる。
